¿Qué son las baterías de litio?
El desarrollo de la sociedad moderna implica un gasto energético considerable cuyo sostenimiento dependerá de la explotación  de nuevas formas de energía renovables, así como del diseño de sistemas de almacenamiento de energía más eficientes. En esto último, y con los continuos avances tecnológicos en dispositivos electrónicos portátiles y en vehículos eléctricos, surge la pregunta: ¿Cuál es el rol de que juegan las baterías y qué tan importante son para solucionar el problema de la creciente demanda de almacenamiento de energía?
de nuevas formas de energía renovables, así como del diseño de sistemas de almacenamiento de energía más eficientes. En esto último, y con los continuos avances tecnológicos en dispositivos electrónicos portátiles y en vehículos eléctricos, surge la pregunta: ¿Cuál es el rol de que juegan las baterías y qué tan importante son para solucionar el problema de la creciente demanda de almacenamiento de energía?
Una batería o pila es un dispositivo compuesto por una o más celdas electroquímicas[1] individuales, compuestas a su vez por dos barras metálicas o electrodos, que están hechas a base de materiales conductores y que están inmersas en un líquido, llamado electrolito,[2] capaz de conducir iones (átomos con un desbalance de electrones). Este sistema es capaz de producir energía eléctrica por medio de reacciones químicas que suceden en su interior.
Entonces, ¿qué tipo de electrodos y de electrolitos se deben seleccionar para almacenar la mayor cantidad de energía?
Una pila hecha en casa

La figura de la izquierda muestra el diseño de un sistema de baterías casero hecho con limones[3]. Esta “pila de limones” está compuesta por 3 celdas (o limones) individuales conectadas en serie. Cada celda está compuesta por 2 electrodos de metales diferentes (cobre y zinc) que están sumergidas en el ácido del limón, el mismo que actúa como electrolito. A pesar de que la energía producida por este circuito en serie es capaz de encender un diodo LED, este dispositivo no es lo suficientemente eficiente para ser usado, por ejemplo, en nuestros teléfonos celulares
Para ir más allá en la búsqueda de una mejor batería, debemos echar mano de algunas definiciones que trataremos de explicarlas de forma simple:
- La diferencia de potencial de la celda: Antes que nada, definamos el concepto de potencial de reducción, que es una cantidad expresada en voltios (V) que mide la capacidad de un electrodo para ganar electrones. Algunos de estos potenciales están tabulados en tablas[4]. En palabras simples, la diferencia de potencial electroquímico de la celda es la diferencia entre los potenciales de reducción de las especies que intervienen en la reacción. Es posible tener una idea del valor de este voltaje midiendo con un multímetro los bornes o extremos de una pila cargada. Así, una sola celda de la pila limón puede suministrar valores cercanos a los 0,9 V. Las pilas alcalinas[5], por ejemplo las tipo AA suministran típicamente 1,5 V (pudiendo alimentar a un pequeño juguete o un control remoto), mientras que las actuales pilas de ion-litio[6] suministran alrededor de 3,6-3,8 V (usadas en teléfonos celulares). Las celdas se pueden apilar en serie para dar mayor voltaje (por ejemplo, los packs que se encuentran en una bicicleta eléctrica están compuestos de varias baterías ion-litio pudiendo dar hasta 36 V).
- La capacidad electroquímica específica de la celda: La capacidad de un electrodo es la cantidad máxima de corriente eléctrica que puede pasar por una porción de masa de electrodo en un determinado periodo de tiempo durante una reacción electroquímica. La capacidad puede expresarse en amperios-hora por kilogramo (Ah/kg). En una pila, la capacidad de la celda está limitada por el electrodo que posee la menor capacidad.
- La energía especifica de la batería: Se obtiene multiplicando las dos definiciones anteriores y se expresa en unidades de watios-hora por kilogramo (Wh/kg). Este es un valor teórico, que en la práctica es difícil de alcanzar. Sin embargo, a modo de comparación, una celda de las baterías plomo-acido de automóvil tienen energías especificas de tan solo 35-40 Wh/kg; mientras que las pilas ion-litio pueden alcanzar los 250 Wh/kg, razón por la cual son ahora tan populares, más energéticas y más ligeras.
El litio y las baterías ion-litio
En la historia de las baterías, se experimentó con diferentes tecnologías pasando por el zinc-carbono, plomo-acido, níquel-cadmio, etc. En cada etapa, se lograba una mejora en la energía específica (Wh/kg, dispositivos más ligeros) y en la densidad de energía (Wh/litro, dispositivos más pequeños). Sin embargo, existe un material con el potencial de reducción más bajo de todos: el litio. Esto permite tomarlo como potencial de referencia (diremos cero voltios versus litio, 0 V vs. Li/Li+) y de esta forma, solo tendríamos que preocuparnos por encontrar otro material con un alto potencial y una gran capacidad (ver en figura 2, materiales positivos). El litio siempre es el electrodo negativo durante la carga de la batería. Otra de sus ventajas es su gran capacidad (3860 Ah/kg), aunque, como se ve en la figura, la capacidad de la celda siempre estará limitada más bien por el electrodo positivo que es de menor capacidad.[7]
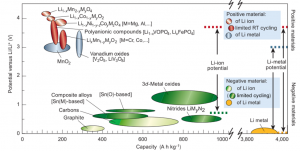
Entre los materiales de electrodo positivo más usados en la actualidad podemos mencionar: los electrodos del tipo óxido de litio cobalto (LiCoO2, llamado LCO) con potenciales hasta 4.0 V y capacidades de 150 Ah/kg. Más recientemente, los óxidos de litio, níquel, manganeso y cobalto (LiNixMnyCozO2, llamado NMC) alcanzan los 4.3 V y 200 Ah/kg de capacidad. Estos materiales pueden insertar iones de litio en su estructura y de ahí su importancia.
Cuando juntamos estos materiales positivos con el litio tenemos la llamada batería litio metal. Aquí, es importante saber que para que este dispositivo funcione el electrolito debe contener una sal compuesta por iones de litio. Durante la carga, estos iones se convierten en metal que se deposita sobre el electrodo de litio. Durante la descarga, este litio depositado regresa al electrolito y luego se inserta en el electrodo positivo. Se espera de esta forma que este proceso de ida y vuelta (plateado y decapado sobre el electrodo de litio) sea reversible con una eficiencia muy cercana al 100 %.

Aunque muy prometedor en teoría, en la práctica casi todos los electrolitos sufren fuertes degradaciones en contacto prolongado con el litio una vez que se empieza a cargar la batería. En segundo lugar, y al mismo tiempo, el depósito sobre el electrodo de litio no es 100 % eficiente y en la mayoría de los casos da lugar ya sea a la acumulación de litio que no regresa al electrodo positivo. Por otro lado, se ha demostrado también que el litio se deposita en sitios específicos donde crece en forma de ramificaciones llamadas dendritas que provocan cortocircuitos.
Para evitar este problema, el litio fue reemplazado por otros materiales que también pueden insertar iones de litio, pero que además tienen un potencial suficientemente bajo. El más popular de estos materiales negativos es el grafito con un potencial de 0.2 V, que se empezó a comercializar por Sony en 1991 dando lugar al nacimiento de la tecnología ion-litio, que es la que domina actualmente el mercado.
Dominar el litio metal o cambiar de tecnología
Teniendo en cuenta los nuevos compromisos energéticos y la promesa del uso extensivo de automóviles eléctricos en el nuevo milenio, se retomó la idea de diseñar baterías litio-metal que pueden ofrecer mucha más energía que las ion-litio. Entre las promesas actuales se puede mencionar la batería litio-azufre (650 Wh/kg) y la batería litio-aire (950 Wh/kg), cuyo principio no explicaremos, pero solo recalcaremos que usan el litio como electrodo negativo y el azufre y el oxígeno del aire, respectivamente, como positivo.
Mientras tanto, una estrategia para detener el crecimiento de las dendritas de litio consiste en usar electrolitos hechos de polímeros como el polióxido de etileno (PEO), además de sólidos cerámicos como el oxinitruro de litio y fósforo (LiPON), pero la conductividad de estos es por ahora muy baja y no resuelven todos los problemas.
Para terminar, mencionaremos que en la investigación actual se plantean otros caminos que no pasan por el litio, de esta forma se tienen las baterías a base de ion-magnesio y las de ion-sodio. A pesar de esto, el litio es aún considerado por muchos científicos como el Santo Grial de las baterías.
El autor
 Jorge Morales Ugarte es egresado de la especialidad de ingeniería física por la Universidad Nacional de Ingeniería. Realizó estudios de maestría y doctorado en la Universidad Grenoble-Alpes de Francia, con énfasis en la ciencia de los materiales y la electroquímica. Actualmente continúa su investigación en el área de baterías de litio en España.
Jorge Morales Ugarte es egresado de la especialidad de ingeniería física por la Universidad Nacional de Ingeniería. Realizó estudios de maestría y doctorado en la Universidad Grenoble-Alpes de Francia, con énfasis en la ciencia de los materiales y la electroquímica. Actualmente continúa su investigación en el área de baterías de litio en España.
Referencias y Bibliografía
[1] Electroquímica, disciplina que estudia las transformaciones químicas producidas por corrientes eléctricas y la producción de tales corrientes por medio de la transformación de sustancias químicas (Electroquímica moderna, J. Bockris & A. Reddy, Editorial Reverté).
[2] Actualmente, existen también electrolitos sólidos (polímeros y cerámicos).
[3] https://en.wikipedia.org/wiki/Lemon_battery
[4] https://en.wikipedia.org/wiki/Standard_electrode_potential_(data_page)
[5] Pila alcalina: electrodos de zinc y dióxido de manganeso, electrolito hidróxido de potasio
[6] No confundir con la batería litio-metal, que usa exclusivamente el litio como electrodo negativo
[7] En la literatura, también se suele hablar de materiales de cátodo (electrodo positivo) y materiales de ánodo (electrodo negativo).

