Resumen: En este artículo se describirá brevemente el proceso multidisciplinario del descubrimiento de fármacos y la importancia de la química medicinal en la optimización de compuestos bioactivos. El objetivo es mostrar lo meticuloso que puede ser desarrollar un fármaco y desmitificar a la química mostrándola en una de las aplicaciones más comentadas y utilizadas por la coyuntura actual en la búsqueda de nuevos medicamentos.
Resumen: En este artículo se describirá brevemente el proceso multidisciplinario del descubrimiento de fármacos y la importancia de la química medicinal en la optimización de compuestos bioactivos. El objetivo es mostrar lo meticuloso que puede ser desarrollar un fármaco y desmitificar a la química mostrándola en una de las aplicaciones más comentadas y utilizadas por la coyuntura actual en la búsqueda de nuevos medicamentos.
El ser humano ha demostrado a lo largo de la historia su capacidad de sobrevivencia y adaptación a cambios y desafíos. Cuando se ha enfrentado a enfermedades desconocidas, ha utilizado su inteligencia y creatividad para encontrar soluciones y mitigar esos males observando a la naturaleza y adaptando los recursos de su entorno a su favor. Antiguamente, eran utilizadas plantas medicinales para el tratamiento de enfermedades basadas en la observación de su uso, claro ejemplo es el de Perú donde esta práctica se ha ejecutado y sostenido a lo largo de los años. Sin embargo, el avance científico y tecnológico ha cambiado el panorama cuando se habla de medicamentos. No hablamos sólo de eficacia, sino también seguridad, por ello la creación de agencias reguladoras que protejan al potencial público de consumo se volvió inminente y necesario. Antes de comenzar este relato es muy importante diferenciar a los fármacos de los medicamentos. Técnicamente hablando, se denomina fármaco al principio activo del medicamento, es decir, una sustancia química o biológica con estructura conocida y responsable del efecto terapéutico. Mientras que el término medicamento se refiere a la mezcla del fármaco con excipientes, estos últimos son aditivos del fármaco que buscan estabilizar, vehiculizar, modificar propiedades organolépticas, mejorar biodisponibilidad entre otras propiedades.
A comienzos del siglo XX, Estados Unidos estaba inmerso en propagandas de medicamentos ineficientes y peligrosos donde el público no sabía lo que consumía. En 1906 se aprobó el acta “Pure Food and Drugs Act” marcando el inicio para la creación de la entidad que ahora conocemos con el nombre de FDA (del inglés Food and Drug Administration). Sin embargo, en la etapa inicial esta entidad no tenía autoridad para sacar del mercado diversos productos ofrecidos como “medicamentos milagrosos”. Mediante una fuerte presión mediática, en el año 1933 se expuso una lista de 100 productos peligrosos que esa institución no podía sacar del mercado, hecho que quedó documentado en 1936 en un libro de Ruth de Forest Lamb, directora de educación de la institución en esa época (Figura 1 y 2). Posteriormente en 1938 se firmó el acta “The Federal Food, Drug, and Cosmetic Act” donde se estableció que los productos farmacéuticos y cosméticos deben pasar por un proceso de control y etiquetado adecuado, colocando a la FDA como ente regulador para asegurar que los fármacos presenten eficacia y seguridad antes de salir al mercado.


Estos hechos históricos nos llevan a comprender por que con el pasar de los años las exigencias de aprobación y regulación de medicamentos se han ido refinando, siendo mucho más estrictas que en el pasado para poder garantizar que los medicamentos con aprobación de circulación en el mercado, sean productos seguros para los consumidores y que cumplan estrictamente la función encontrada en tratar enfermedades.
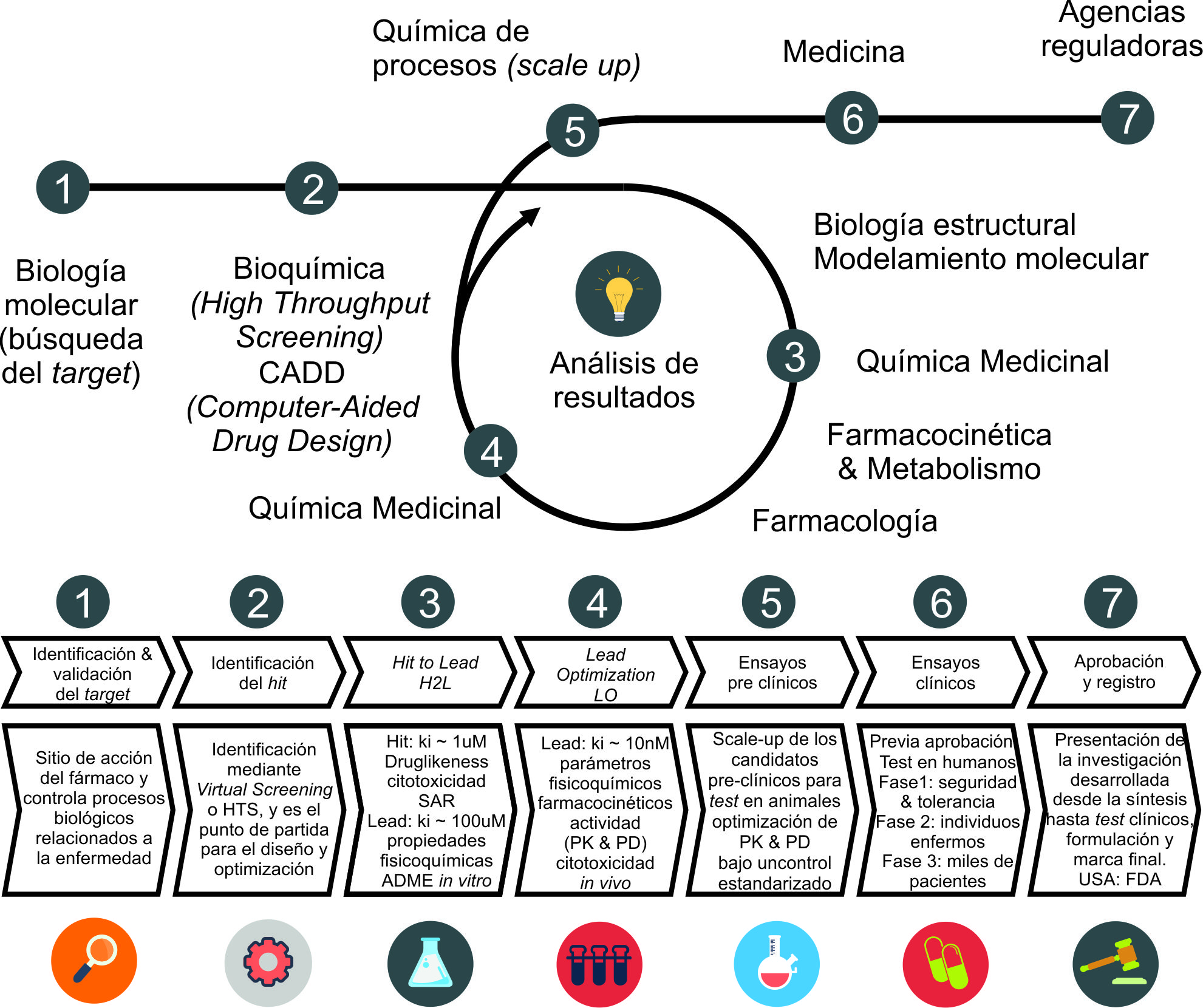
Siendo los fármacos el principio activo de los medicamentos, una pregunta emergente es: ¿Cuál es el proceso de descubrimiento de fármacos? (Figura 3)
El proceso comienza con la selección del “target” que es el sitio de acción para el fármaco (en esta etapa inicial son referidos como ligandos) y controla los procesos biológicos relacionados a la enfermedad de estudio, este debe ser validado garantizando su selección como guía en el proceso de descubrimiento (es decir, se realiza un estudio para entender cómo “atacar” a la enfermedad de un modo eficiente), esta aproximación recibe el nombre de SBDD (del inglés Structure Based Drug Design). Cabe mencionar que también pueden ser diseñados fármacos sin contar con un target definido, en ese caso la aproximación de estudio sería del tipo LBDD (del inglés Ligand Based Drug Design).
Con el target definido se procede al screening de compuestos, el cual puede realizarse por HTS (del inglés High Throughput screening) donde la actividad biológica de gran cantidad de compuestos es determinada por equipos automatizados, o por VS (del inglés Virtual Screening) el cual realiza el screening in silico (en computador) de gran cantidad de compuestos procedentes de algún banco de datos y así identifica posibles ligandos al target de estudio.
Después de la elección del hit (nombre que recibe el ligando en esta etapa), se procede al diseño y planificación de las modificaciones, estas etapas son H2L (del inglés Hit to Lead) y LO (del inglés Lead Otimization) que están relacionadas a la optimización de las estructuras químicas que además de la actividad biológica, consideran a los procesos biológicos ADME (Absorción, Distribución, Metabolismo y Excreción), que son fases por las cuales todo fármaco diseñado para uso oral atraviesa cuando entra al organismo. Este control considera la optimización de parámetros fisicoquímicos, toxicidad y estabilidad metabólica utilizando modelos de sistemas biológicos in vitro e in vivo.
Las consideraciones farmacológicas controladas y optimizadas en las etapas H2L y LO son mejoradas en la etapa pre-clínica, con la diferencia que en esta última la metodología sintética es modificada para garantizar una mayor escala de producción y conseguir monitorear los parámetros farmacocinéticos (PK) y farmacodinámicos (PD) considerando un control estandarizado en animales.
Después de este proceso de optimización se llega al candidato clínico a fármaco que requiere de la aprobación de la entidad correspondiente en cada país, es necesario una evaluación del estudio llevado hasta ese momento para garantizar que las pruebas en humanos sean seguras, para pasar a las etapas clínicas (Fase clínica I, II y III) donde son evaluados los resultados preliminares obtenidos hasta la etapa pre-clínica y son monitoreados grupos de individuos con el fin de garantizar seguridad y tolerancia del candidato a fármaco además de asegurar una dosis correcta de uso.
A pesar de contar con todos los estudios preliminares antes descritos que perfilan candidatos clínicos óptimos, no se garantiza que al llevarlo a la etapa clínica los resultados sigan manteniéndose alentadores. Cuando la etapa clínica es finalizada con éxito, se garantiza la eficacia y seguridad del nuevo fármaco. La presentación de la información completa de todos los estudios que llevaron a su descubrimiento, adecuada formulación, correcto etiquetado y marca, es el paso final que permite su aprobación y autorización por el ente regulador para salir al mercado, en Estados Unidos la FDA es quien regula esta etapa. Cabe mencionar que después de la aprobación de un fármaco, continúa su control por varios años, es decir, si se presenta el caso de efectos adversos graves puede ser retirado del mercado en cualquier momento. A esa última etapa se le conoce como farmacovigilancia o fase clínica IV.
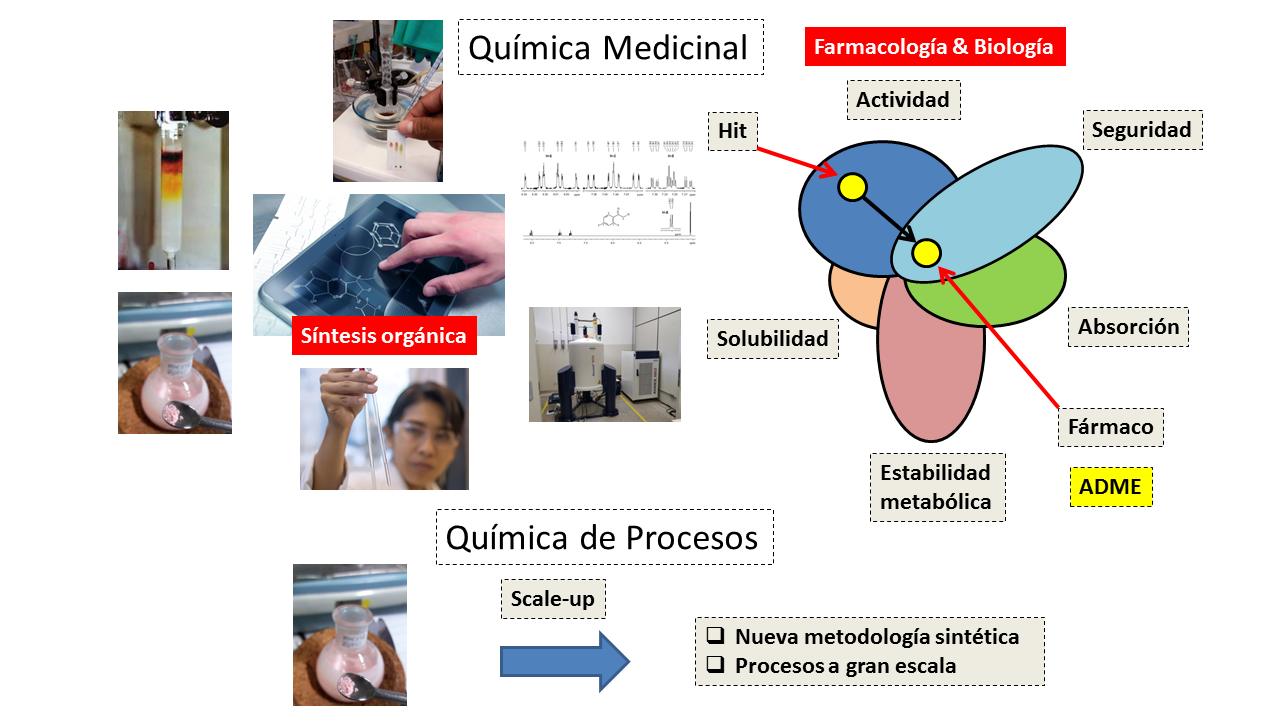
La poca atención al largo proceso de desarrollo de fármacos suele mitificar muchas veces a esta labor como propia de médicos, cuando en realidad es un proceso exigente que engloba un trabajo multidisciplinar de más de un grupo de investigación. La química medicinal está en la interfaz de la síntesis orgánica, farmacología y biología. En las etapas H2L y LO, toma el total protagonismo con el fin de, mediante un diseño ordenado y lógico, proponer y ejecutar modificaciones estructurales que puedan permitir optimizar la actividad biológica observada y así conseguir avanzar en las etapas siguientes.
Además de considerar la actividad biológica, los químicos medicinales tienen que lidiar con un gran número de parámetros de optimización fisicoquímicos, farmacocinéticos y de metabolismo descritos anteriormente, aquí toma mucho sentido la frase de Corwin Hansch: “Nadie está condenado a manejar tantas variables como un químico medicinal”.
Por otro lado, los químicos de procesos son los encargados de hacer el scale-up de la metodología sintética desarrollada por los químicos medicinales. En la etapa pre-clínica se trabaja con órdenes de gramos en masa de compuestos, mientras que en la etapa de optimización anterior los órdenes son de miligramos en masa de compuestos (Figura 4).
Reposicionamiento de fármacos contra el COVID-19
Una pregunta tácita después de esta descripción general sería cuánto tiempo lleva el proceso en ser ejecutado, y la respuesta es de 10 a 15 años en promedio en un proyecto exitoso.
Situados en la emergencia actual causada por la pandemia del COVID-19, con una demanda activa y preocupante de la sociedad por medicamentos nuevos efectivos y seguros, esperar un proceso tan largo como el descrito es poco aplicable. Por eso, existe una estrategia llamada reposicionamiento de fármacos, mediante la cual fármacos ya existentes o candidatos clínicos avanzados (soportadas en estudios preliminares de seguridad) son sometidos a un nuevo screening biológico para poder ser “reutilizados” en otra función, pudiendo “saltar” etapas rápidamente y llegar a la fase clínica.
Un ejemplo de esta estrategia es el caso del fármaco Remdesivir desarrollado por Gilead, inicialmente desarrollado para tratar Hepatitis C, luego reposicionado para tratar el Ebola, y actualmente está en fase 3 de estudios clínicos como tratamiento de replicación del SARS-CoV2. Otro caso interesante es el de la Dexametasona, parte del estudio Recovery de la Universidad de Oxford, un corticosteroide de amplio espectro utilizado por sus efectos antiinflamatorios e inmunosupresores que actualmente es utilizado como tratamiento en la inhibición de la liberación de citoquinas por la infección por SARS-CoV2 mostrando una eficacia de reducción en mortalidad del 33.3% para pacientes con cuadro grave.
Sin duda la aplicación de esta estrategia es una alternativa interesante y factible en la búsqueda de nuevos fármacos contra el COVID-19 y es la que actualmente está siendo utilizada por farmacéuticas y grupos de investigación.
Finalmente, queda demostrada la importancia de una ejecución ordenada y sistematizada en el desarrollo de nuevos fármacos, además de la interdisciplinariedad requerida lo cual desmitifica a las ciencias mostrándolas como base fundamental para el progreso de este tipo de investigaciones y así direccionar el descubrimiento de fármacos eficaces y seguros que puedan suplir las necesidades de la sociedad.
Bibliografía
- 80 Years of the Federal Food, Drug, and Cosmetic Act (https://www.fda.gov/about-fda/virtual-exhibits-fda-history/80-years-federal-food-drug-and-cosmetic-act visitado en 08-09-2020)
- The American Chamber of Horrors album ( https://www.flickr.com/photos/fdaphotos/sets/72157696265674121 visitado en 08-09-2020)
- Wagner, J., Dahlem, A., Hudson, L. et al. A dynamic map for learning, communicating, navigating and improving therapeutic development. Nat Rev Drug Discov 17, 150 (2018). https://doi.org/10.1038/nrd.2017.217
- Stevens, Erland. Medicinal chemistry: the modern drug discovery process, 2014.
- Singh TU, Parida S, Lingaraju MC, et al. Drug repurposing approach to fight COVID-19. Pharmacological Reports: PR. 2020 Sep. DOI: 10.1007/s43440-020-00155-6.
- Remdesivir Clinical Trials (https://www.gilead.com/purpose/advancing-global-health/covid-19/remdesivir-clinical-trials visitado en 08-09-2020)
- Dexamethasone results. The RECOVERY collaborative Group – University of Oxford. (https://www.recoverytrial.net/results/dexamethasone-results visitado en 08-09-2020)
Biografía del autor
 Rocío Marisol Espinoza Chávez es bachiller en Química por la Universidad Nacional de Ingeniería UNI y MSc. en Química Orgánica por la Universidade Estadual de Campinas UNICAMP en Brasil. Actualmente es candidato a doctor en la UNICAMP trabajando en el área de Química Medicinal y Síntesis Orgánica, realizando investigación en los procesos H2L y LO del descubrimiento de fármacos para la enfermedad de Chagas. Creadora de la iniciativa Drug Discovery Perú Networking que busca promover esta área de investigación y construir un network con investigadores y estudiantes peruanos.
Rocío Marisol Espinoza Chávez es bachiller en Química por la Universidad Nacional de Ingeniería UNI y MSc. en Química Orgánica por la Universidade Estadual de Campinas UNICAMP en Brasil. Actualmente es candidato a doctor en la UNICAMP trabajando en el área de Química Medicinal y Síntesis Orgánica, realizando investigación en los procesos H2L y LO del descubrimiento de fármacos para la enfermedad de Chagas. Creadora de la iniciativa Drug Discovery Perú Networking que busca promover esta área de investigación y construir un network con investigadores y estudiantes peruanos.